

LE CHEMINEMENT PLASMATIQUE DES LIPIDES

VLDL
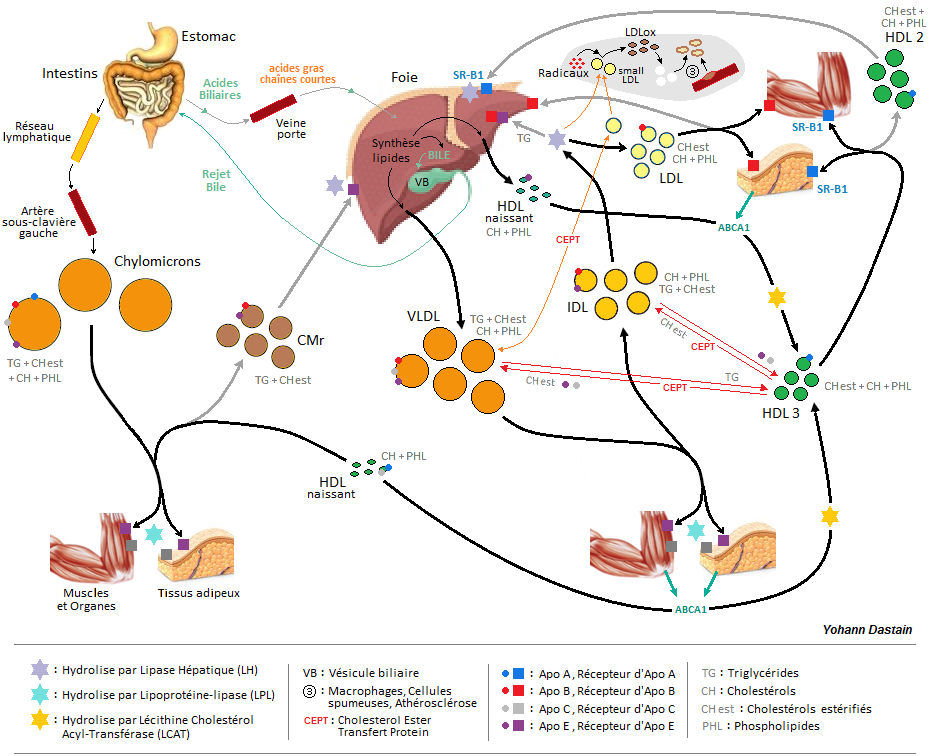
Le foie limite tant que possible son stockage en TG, car le caractère biochimique des acides gras est nocif pour la membrane des hépatocytes. Il le limite également parce que l’accumulation de graisse est préjudiciable à l’activité et l’homéostasie hépatique (au-delà de 5 % d’accumulation on parle de stéatose). Afin d’évacuer ses TG, mais aussi d’autres composants lipidiques, le foie va synthétiser des transporteurs appelés lipoprotéines VLDL (Very Low Density Lipoprotein), composés de TG pour l’essentiel (55 %), de Cholestérol libre et estérifié (19 %), de Phospholipides (18 %), et d’Apolipoprotéines B-C-E (8 %). Mais quel est le rôle des Apolipoprotéines ?
Apo A = permet la reconnaissance des HDL au niveau du foie et des cellules, et active l’enzyme LCAT (estérification du cholestérol libre).
Apo B = permet la reconnaissance des LDL au niveau du foie et des cellules, et permet la diffusion du cholestérol dans les cellules.
Apo C = permet la reconnaissance des Chylomicrons au niveau des cellules, et l’activation de la Lipoprotéine-Lipase (LPL).
Apo E = permet la reconnaissance des lipoprotéines au niveau du foie et des cellules (l'insuline stimule les récepteurs des Apo E et B).
Les VLDL naissants vont être largués dans le réseau sanguin, puis vont se maturer en donnant un peu de leur TG aux HDL en échange d’Apo C-E et de Cholestérol estérifié (action de la CETP : Cholesterol Ester Transfert Protein). Les VLDL vont ensuite aller distribuer leurs composants aux différentes cellules utilisatrices de notre organisme, ceci sous l’action des enzymes LPL (hormono-sensibles, notamment à l'insuline). Les processus de pénétration cellulaire seront identiques à ceux utilisés par les constituants des Chylomicrons.
Ok
IDL et LDL
Sous l’action d’enzymes Lipoprotéine-Lipase (LPL), postées sur les parois des cellules adipeuses et musculaires, un VLDL va libérer progressivement ses composants, et ainsi diminuer en taille, tout en augmentant en densité. Le VLDL va ainsi devenir un IDL (Intermediate Density Lipoprotein).
Grâce à leur Apo E (et B) les IDL vont être captés à la surface du foie et vont y subir l’hydrolyse des Lipases Hépatiques (LH), aussi appelées Triglycéride Lipase Hépatique (TGL-H). Ces enzymes hépatiques vont déposséder les IDL de la quasi-totalité de leur TG, mais une partie de ces IDL appauvris vont se libérer et repartir dans la circulation sanguine, ils s’appelleront désormais LDL (Low Density Lipoprotein). 60 % plus petit qu’un VLDL, la composition en TG du LDL n’est plus que de 6 %, quant au reste : Cholestérol libre et estérifié (50 %), phospholipides (22 %), et Apolipoprotéines B (22 %) (Les Apo C et E ayant été transférées aux HDL en échange d’ester de cholestérol, ceci sous l’effet de la CETP).
Les membranes cellulaires ont des récepteurs qui reconnaissent les Apo B, appelés LDL récepteurs ou LDLR (insulno-sensibles). Ainsi, les LDL vont pouvoir se fixer aux cellules pour y distribuer leur Cholestérol.
La capture des LDL sera régulée par le besoin des cellules réceptrices : selon le niveau de concentration de cholestérol intracellulaire, une cellule va inhiber ou exciter l’action de ses récepteurs Apo B. Par ailleurs, une cellule a également la possibilité d’inhiber son activité enzymatique HGM-CoA réductase afin de réduire son endosynthèse de cholestérol quand ce dernier se trouve en trop grande concentration (bien que le foie représente 70 % de la synthèse endogène, toutes les cellules de notre organisme ont cette capacité de synthèse, excepté celles du tissu nerveux et les globules rouges).
Il faut bien comprendre que même si les VLDL et IDL sont des transporteurs et délivreurs de cholestérol (grâce à leur Apo B), c’est surtout les LDL qui assument la plus grande part de ce travail. Les LDL n’ont quasiment que ça à faire, mais surtout, étant dépourvu d’Apo E, ils restent beaucoup plus longtemps dans le sang : 2 à 3 jours, contre seulement 3 à 4 heures pour les IDL ! (voilà pourquoi les bilans sanguins à jeun ne présentent que des LDL).
Les LDL seront retirés de la circulation par deux moyens :
La bonne façon : La majeure partie des LDL normaux (phénotype A) est recaptée par le foie, faiblement réceptif à l’Apo B (ce qui explique pourquoi les LDL restent si longtemps dans le sang).
La mauvaise façon : Oxydation radicalaire (et aussi enzymatique via cholestérol-oxydase, mais ceci dans une moindre mesure) = développement de l’athérosclérose. Le métabolisme des lipoprotéines peut aboutir à la formation d’un certain nombre de LDL plus petits et plus denses qu’à la normale (phénotype B), ceci en raison d’une lenteur ou d’un défaut de dégradation des VLDL et IDL :
1 - Les VLDL peuvent rester plus longtemps dans le sang dans le cas où ils sont moins bien captés et catabolisés au niveau cellulaire (surproduction hépatique, défaut qualitatif des acides gras alimentaires rendant les TG des lipoprotéines facilement oxydables, trop de Chylomicrons monopolisant les LPL, inhibition des récepteurs cellulaires Apo E-C pour raisons hormonales ou oxydative). À leur tour, mais au niveau hépatique, les IDL peuvent également être moins bien captés ou hydrolysés (trop d’IDL, et inhibition des LH et des récepteurs Apo E-B pour raisons hormonales ou oxydative).
2 - Dans ces conditions les VLDL vont s’adonner à des échanges avec des LDL normaux en leur donnant des TG, et en leur prenant du Cholestérol estérifié (CEPT), ce qui aboutit à la modification de LDL phénotype A en LDL phénotype B.
3 - Une trop forte concentration plasmatique d’IDL déclenchera les mêmes échanges (mais entre IDL et LDL normaux) et aura donc les mêmes conséquences. Par ailleurs les IDL peuvent également donner naissance à des LDL phénotype B dans le cas où les IDL sont moins bien captés et hydrolysés au niveau hépatique.
4 - Les LDL phénotype B restent plus longtemps dans le sang car ils présentent une moins bonne affinité avec les récepteurs d’Apo B. Ayant une certaine quantité de TG, mais étant faiblement chargés en anti-oxydants, ces LDL sont plus vulnérables au stress oxydatif (radicaux Libres = agents pro-oxydants, dont les acides gras des lipoprotéines sont des cibles privilégiées). Ces défauts font que les LDL phénotype B sont des lipoprotéines au fort potentiel athérogène : lorsque les LDL phénotype B, grâce à leur petite taille, s’infiltrent dans les brèches endothéliales des parois artérielles lésées, elles s’y font piéger puis oxyder par les radicaux libres. Ces LDL deviennent ainsi des LDLox, qui se font capter par les récepteurs/transporteurs scavengers des macrophages (et CML). C’est là le début d’un processus complexe développant l’athérosclérose. À noter que les LDL phénotype B peuvent également se faire oxyder dans le sang, ainsi que lors de leur passage près d’une zone artérielle lésée, ces LDLox se font alors internaliser dans la paroi sous l’attraction des récepteurs/transporteurs scavengers des macrophages (et CML) (voir les articles sur le développement de l’athérosclérose, aux conséquences multiples et graves pour la santé).
Ok
HDL
Quand une cellule est trop chargée en cholestérol, elle en inhibe son endosynthèse, stoppe son captage de LDL, et elle évacue le cholestérol excédentaire. Entre alors en jeu les HDL (High Density Lipoprotein), ils sont chargés d’épurer l’organisme du cholestérol excédentaire en le récupérant sur les parois cellulaires, puis en le ramenant jusqu’au foie, organe où les HDL seront alors dégradés et recyclés (le cholestérol sera notamment transformé en acides biliaires).
Une partie des HDL provient de la dégradation des Chylomicrons (origine intestinale, puis synthèse sanguine), l’autre partie étant synthétisée par le foie. Au terme de leur synthèse hépatique, les HDL se composent de phospholipides, de Cholestérol libre, et d’Apo E, puis ils sont libérés dans le sang sous forme native discoïdale. Pour devenir mature, le HDL naissant va capter du cholestérol au niveau des cellules, puis l’enzyme LCAT (Lécithine Cholestérol Acyl-Transférase) va hydrolyser la Lécithine, dont l’acide gras va se coupler avec le cholestérol. Ce dernier, désormais estérifié, va pénétrer au cœur du HDL naissant, qui devient ainsi sphérique, on l’appelle HDL 3 (petite taille, TG 3 %, CHol et CHol ester 17 %, Phospholipides 25%, Apo A 55%). Cette classe de HDL mature dispose désormais de très peu de cholestérol libre au niveau périphérique. Grâce aux récepteurs Apo A des cellules, les HDL 3 vont se fixer sur ces dernières afin d’en récupérer le cholestérol excédentaire, qui sera lui à son tour estérifié (action de la LCAT). Les ABCA1 et SR-B1 sont des protéines transporteuses permettant l’efflux membranaire du cholestérol intra-cellulaire excédentaire vers les HDL. Les ABCA1 reconnaissent les HDL naissants, tandis que les SR-B1 reconnaissent les HDL 3.
Un HDL 3 va donc grossir au fur et à mesure de son voyage (plusieurs jours), pour devenir finalement un HDL 2 (légèrement plus gros, TG 5 %, CHol et CHol ester 22 %, Phospholipides 55%, Apo A 40%). Les HDL 2 sont recaptés par le foie (réceptif à l’Apo A), le cholestérol s’y fera alors décharger par les SR-B1 hépatiques. Les phopholipides seront recyclés, les TG seront hydrolysés par la Lipase Hépatique, quant au recyclage du cholestérol : voir fin de l’article "Les lipides endo-synthétisés".
Durant leur séjour sanguin les HDL peuvent pénétrer (grâce à leur petite taille) dans les zones lésées de l’endothélium artériel pour y récupérer du cholestérol capté par les macrophages et les cellules spumeuses : ces deux derniers possèdent des transporteurs ABCA1, ABCG1 (et SR-B 1) qui reconnaissent, respectivement, la présence des HDL naissants et matures. Il y aura dons un efflux de cholestérol vers les HDL, qui ont ainsi la qualité de pouvoir enrayer la progression de l’athérosclérose, et même, de pouvoir inverser le processus si toutes les conditions sont réunies (voir les articles dédiés à l'Athérosclérose).
En se croisant dans le sang, lipoprotéines et HDL effectueront des échanges de composants :
- Un HDL peut donner de l’ester de cholestérol à toutes les autres classes de lipoprotéine, en échange de TG (effet de l’enzyme Cholesterol Ester Transfer Proteins : CETP).
- Le transfert de phospholipides entre lipoprotéines se produit sous l’effet de l’enzyme PLTP.
- Les HDL se chargent temporairement en Apo E et C : Ils les récupèrent aux IDL en échange d’ester de cholestérol, et les donnent aux VLDL naissants en échange de TG.
Copyright © 2025 BODYBUILDING-COACH.FR
All Rights Reserved - Textes et Contenu déposés et protégés - Website developed by Yohann DASTAIN
--> Photos des Compétitions et des Compétiteurs : cliquez sur l'un des logos
--> Photos des Compétitions et des Compétiteurs : cliquez sur le logo
Bodybuilding Masculin, focus sur
Chris Bumstead
Chris Bumstead
• 2015 - CBBF Championships, Men’s Junior, 1st
• 2016 - CBBF Championships, Open Heavyweight, 2nd
• 2016 - IFBB North American Championships, 1st (Pro Card)
• Mr Olympia Classic Physique : 2nd in 2017 and 2018 ; Winner from 2019 to 2024
• 2016 - CBBF Championships, Open Heavyweight, 2nd
• 2016 - IFBB North American Championships, 1st (Pro Card)
• Mr Olympia Classic Physique : 2nd in 2017 and 2018 ; Winner from 2019 to 2024


Histoire du Bodybuilding, Rétrospective sur
Larry Scott
Larry Scott
» Ses meilleurs résultats :
• 1959 - Mr. Idaho, Winner
• 1960 - Mr. California - AAU, Winner
• 1961 - Mr. Pacific Coast - AAU, Winner
• 1962 - Mr. America IFBB, Winner
• 1963 - Mr. Universe IFBB, 1st in Medium
• 1964 - Mr. Universe IFBB, Winner
• 1965 - Mr. Olympia, Winner
• 1966 - Mr. Olympia, Winner
• 1960 - Mr. California - AAU, Winner
• 1961 - Mr. Pacific Coast - AAU, Winner
• 1962 - Mr. America IFBB, Winner
• 1963 - Mr. Universe IFBB, 1st in Medium
• 1964 - Mr. Universe IFBB, Winner
• 1965 - Mr. Olympia, Winner
• 1966 - Mr. Olympia, Winner










.png)
.png)
.png)



