

LA GLYCOLYSELA GLYCOLYSELA GLYCOLYSE

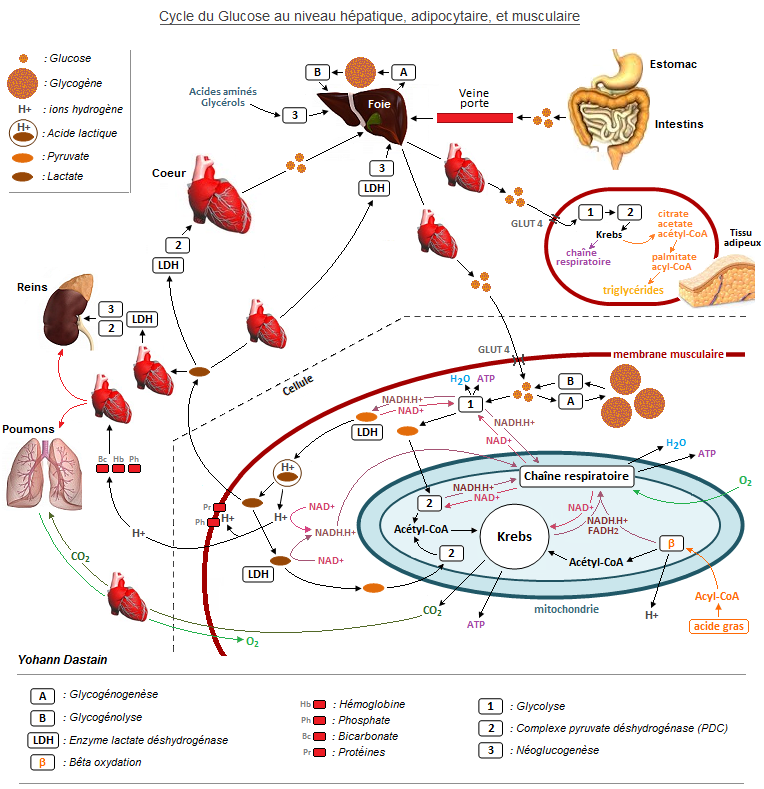
La Glycolyse se déroule dans le cytoplasme (milieu cellulaire). Dès son entrée dans la cellule le glucose est phosphorylé en glucose-6-phosphate (par l’enzyme hexokinase). Ce G-6-P est ensuite transformé en fructose-6-phosphate (par l’enzyme Glucose-6-phosphate isomérase), qui à son tour sera transformé pour devenir du fructose-1-phosphate (par l’enzyme phosphofructokinase-1). Puis de nombreuses autres enzymes vont tour à tour entrer en action, si bien qu’au final une molécule de glucose donnera naissance à 2 moles de pyruvate (acide pyruvique). Le processus glycolyse engendrera également 2 moles d'eau, 2 ATP, et 2 moles de coenzymes réduits NADH,H+ : des coenzymes oxydés (NAD+) se chargent chacun de 2 ions hydrogène (H+, également appelé proton) pour former des coenzymes réduits (NADH,H+), ces derniers serviront à la synthèse d’ATP via la "Chaine respiratoire".
La dégradation d'une molécule de glucose engendre donc de l’énergie, mais essentiellement de façon indirecte, car c'est le pyruvate généré qui fournira le plus d'ATP de par les transformations qu'il va subir : en pénétrant dans les mitochondries des cellules, le pyruvate va subir l’action de 3 enzymes (complexe pyruvate déshydrogénase : PDC) qui vont le transformer en acétyl-CoA (processus fournissant au passage 2 NADH,H+). Cet acétyl-CoA entrera ensuite dans le cycle de Krebs.
Rappel du cheminement plasmatique
Apport nutritif :
Intestin –> foie –> cœur –> artères –> artérioles –> capillaires artériels –> liquide interstitiel –> cellules
Apport en oxygène :
Poumons –> cœur –> artères –> artérioles –> capillaires artériels –> liquide interstitiel –> cellules
Évacuation des déchets (CO2, ions hydrogène, radicaux libres) :
Cellules –> liquide interstitiel –> capillaires veineux –> veines –> cœur –> organes détoxifiants (poumons, foie, reins)
Cycle de Krebs
L’acétyl-CoA alimente le cycle de Krebs (toujours dans les mitochondries). Ce cycle est producteur de coenzymes réduits qui s'avèrent être des précurseurs à la formation d'ATP. Krebs fonctionne en aérobiose, car même s'il n'utilise pas directement d’'oxygène il aura absolument besoin des coenzymes oxydés sortant de la Chaine respiratoire, qui elle nécessite un apport direct d'O2.
Les nombreuses étapes du cycle de Krebs aboutiront à la naissance de 2 ATP, de 10 coenzymes réduits (6 NADH,H+ et 4 FADH2), et de 6 moles de dioxyde de carbone (CO2, également appelé gaz carbonique). Le CO2 sera rejeté de la cellule vers le sang, puis sera acheminé jusqu’aux poumons (par l’intermédiaire des globules rouges principalement) pour être évacué de l’organisme via les voies respiratoires.
Évacuation du CO2
Au sortir de la cellule, alors que seulement 10 % du CO2 se dissout dans le plasma pour ensuite être évacué au niveau pulmonaire, 90 % de celui-ci pénètre dans les globules rouges (alors que l’oxygène en sort). Un tiers du CO2 s’y fixe à l’hémoglobine (HbCO2), et les 2 tiers restant se combinent à l’eau présente (H2O) sous l’effet de l’enzyme anhydrase carbonique, formant ainsi de l’acide carbonique (H2CO3-). Ce dernier va se dissocier en H+ (se fixant alors à l’hémoglobine = HHb), et en bicarbonate (HCO3-) qui lui va sortir du globule rouge en échange d’une pénétration d’anion chlore CL- (c’est l'effet hamburger : maintien de l'électroneutralité). Au niveau pulmonaire l’oxygène expulse le CO2 et les H+ fixés à l’hémoglobine. Le gaz carbonique sort alors du globule rouge pour être rejeté de l’organisme via les poumons, et chaque H+ se fixe sur du HCO3- (qui revient dans le globule rouge en échange du rejet d’anion chlore CL-) formant de nouveau de l’H2CO3-. Ce dernier, sous l’effet de l’enzyme anhydrase carbonique, se dissocie en H2O et CO2, le gaz carbonique sort alors du globule rouge pour être enfin excrété de l’organisme via la voie pulmonaire.
La Chaîne Respiratoire
Au sortir de Krebs les coenzymes réduits pénètreront dans un autre cycle de transformation appelé Chaîne respiratoire (située sur la membrane interne mitochondriale) qui recyclera les NADH,H+ et FADH2 par voie de phosphorylation oxydative afin de synthétiser 32 ATP (les coenzymes réduits issus de la glycolyse et de l’oxydation du pyruvate suivent le même chemin). La chaine respiratoire a besoin d’oxygène pour fonctionner, et outre la synthèse d’ATP qu’elle génère, elle synthétisera également 10 moles d’eau (1 atome d’oxygène + 2 atomes d’hydrogène = H2O). Une fois les coenzymes réduits recyclés, la Chaine respiratoire les rejette sous forme oxydée, appelée FAD et NAD+, afin qu’ils aillent à nouveau se charger en ions hydrogène H+ (formant ainsi de nouveaux coenzymes réduits).
Ainsi, à partir d’une molécule de glucose, la Glycolyse + Krebs + la Chaîne respiratoire permettent au total la synthèse de 36 ATP, qui seront utilisés par la cellule (détails : 4 ATP + 10 NADH,H+ synthétisants 30 ATP + 4 FADH2 synthétisants 4 ATP = 38 ATP, mais on retire 2 ATP nécessaires à la pénétration mitochondriale des NADH,H+ issus de la glycolyse).
Surproduction de Pyruvate et d’ions hydrogène
Cela concerne principalement les muscles. Lors de la glycolyse le pyruvate produit ne pénètre jamais en totalité dans les mitochondries. Plus une sollicitation musculaire est intense, plus la dégradation de glucose s’accroît, engendrant donc une production de pyruvate et d'H+ de plus en plus importante dans le muscle. Leur concentration intramusculaire (cytosol) peut devenir trop quantitative dans la mesure où la vitesse de pénétration mitochondriale du pyruvate s’avère bridée, tout comme le rendement de Krebs (bridé par l’afflux d’oxygène). La régénération des NAD+ par les mitochondries a également ses limites. Par ailleurs, lors d’un effort intense le positionnement anatomique des fibres musculaires diminue considérablement l’irrigation sanguine des myocytes, l’apport en oxygène tant utile à Krebs se fait donc plus rare et l’efflux des déchets intramusculaires s'en trouve limité.
Afin de ne pas ralentir la glycolyse, une partie des NAD+ chargés en H+ (donc des NADH,H+) décideront de ne plus transmettre aux mitochondries leur 2 H+ ramassés lors de la dégradation du glucose, et choisiront plutôt d'aller directement se fixer au pyruvate surproduit. Sous l’action extrêmement rapide de l’enzyme lactate déshydrogénase (LDH), le NAD+ va se libérer (et ainsi rapidement retourner vers la glycolyse), et le pyruvate (C3H3O3) couplé à 3 H+ va donc se transformer en acide lactique (C3H6O3). Mais une molécule d’acide lactique est un produit se dissociant quasi-instantanément, engendrant immédiatement dans le cytosol une molécule lactate (C3H5O3) et 1 H+. On ne peut donc pas vraiment donner de l’importance au terme "acide lactique".
S’accumulant dans le cytosol musculaire, les H+ libres vont exprimer leur effet acidifiant (le pH intramusculaire va chuter), ce qui engendre une douleur intramusculaire, inhibe la glycolyse (qui n’a plus de NAD+ disponible), et bloque la contraction : l’acidité inhibe les actions enzymatiques, et notamment celle de l’ATPases qui hydrolyse l’ATP afin de libérer de l’énergie, la mécanique de chevauchement actine/myosine dans les myofibrilles devient donc impossible. Le sportif n’a alors d’autre choix que de couper ou réduire son effort afin que le muscle puisse évacuer l’excédent de H+ et recycler les lactates, le cycle de Krebs doit absolument reprendre l’avantage. Quel que soit le degré d’intensité d’un effort musculaire il y a toujours une production de lactate et d’H+, donc une hyper-acidose intramusculaire ne sera liée qu’au degré de mobilisation de vos myocytes. À noter qu’un entrainement spécifique peut permettre à un sportif d’accroitre sa résistance musculaire à l'acidose (des modifications structurelles s’opèrent alors dans les myocytes, notamment un développement du système capillaire et une plus grande présence de mitochondries).
Le devenir des ions hydrogène (H+)
Les NAD+ recaptent une faible partie des H+, puis les réutilisent au niveau mitochondrial afin de fournir de l’ATP à la cellule (via la Chaine respiratoire). Un manque d’oxygénation limitera donc en partie le recyclage des H+ par manque de NAD+ produits depuis la Chaine respiratoire.
Concernant la majeure partie des H+ : à l'intérieur des cellules ils seront captés par les systèmes tampons intracellulaires (rôle des protéines et du phosphate), et concernant les H+ rejetés de la cellule ils seront captés par les systèmes tampons plasmatiques (rôle assuré à 60 % par le bicarbonate (HCO3-), à 30 % par l’hémoglobine, et à 10 % par le phosphate). Ces tampons ont la capacité de prendre ou de rejeter des H+ en fonction de la situation acido-basique. Cela permet de limiter la baisse du pH intramusculaire à 6,40 en moyenne (7,05 étant l’équilibre), et celle du pH sanguin à 7,10 en moyenne (7,40 étant l’équilibre). Cependant, les systèmes tampons ont leur limite, et lorsque l’organisme produit une trop grande quantité d’acide des réactions biochimiques sont entreprises par les systèmes pulmonaire et rénal afin d’évacuer le trop plein d’ions hydrogène.
Certains organismes gèrent moins bien l’acidité que d’autres, ils doivent donc redoubler d’effort pour limiter la survenue d’une pathologie appelée "acidose lactique". Celle-ci survient quand les tissus présentent des difficultés d’oxygénation, et quand l’organisme a des difficultés à recycler les ions hydrogène : la concentration protonique intra et extra-cellulaire augmente alors, causant l’acidose.
Exceptionnellement cela peut être le fruit d’un effort trop intense (surproduction d’acide lactique), mais généralement l’acidose lactique est la conséquence d’une ou de plusieurs défaillances physiologiques : défaut quantitatif de mitochondries ou de globules rouges, défaut fonctionnel pulmonaire, hépatique, ou rénal (3 organes détoxifiants), insuffisance cardiaque, diabète, ou encore tumeur maligne. Toutes ces causes peuvent être congénitales, mais également le résultat d’une mauvaise hygiène de vie.
Les troubles consécutifs à l’acidose lactique sont : l’épuisement respiratoire, des troubles de la coagulation, une insuffisance rénale ou hépatique, et des troubles de la conscience (qui peuvent même aller jusqu’au coma dans le cas où l’hypoxie et l’acidose deviennent trop importantes au niveau du cerveau).
Évacuation des ions Hydrogène (H+)
Une fois dans le sang les H+ sont fixés par des substances tampons : bicarbonate, hémoglobine, et phosphate.
Voie pulmonaire
Un bicarbonate plasmique (HCO3-) fixe un H+, formant ainsi de l’H2CO3- (acide carbonique). Ce dernier se dissocie en H2O et CO2, le gaz carbonique est alors excrété de l’organisme via les poumons. Toujours au niveau pulmonaire, l’oxygène pénètre dans les globules rouges et expulse les H+ qui se sont fixés à l’hémoglobine (HHb) lors de leur sortie cellulaire. Chaque H+ va alors être fixé par du bicarbonate (HCO3-) présent dans les globules rouges, formant ainsi de l’H2CO3- . Ce dernier, sous l’effet de l’enzyme anhydrase carbonique, se dissocie en H2O et CO2, le gaz carbonique est alors rejeté des globules rouges pour être excrété de l’organisme via les poumons.
Voie rénale/urinaire
L’acide carbonique formé à partir d’H+ et de bicarbonate sera également traité au niveau rénal. Les reins filtrent l’H2CO3- en le dissociant en bicarbonate et H+. Le bicarbonate retourne alors dans la circulation sanguine, mais s'il s'y retrouve en trop forte concentration une partie sera alors évacuée via les urines. Quant aux H+, l’essentiel se retrouvera dans les urines sous leur forme composée (ammonium et phosphate monosodique), alors qu’une faible partie s’y retrouvera directement sous leur forme libre.
Provenant de l’urée, l’ammoniac (NH3) va fixer un H+ pour ainsi devenir de l’ammonium (NH4+), qui sera excrété via l’urine.
Le système phosphate pour tampon
Le phosphate disodique (Na2HPO4, ou hydrogénophosphate de sodium) peut se charger d’H+ quand un milieu devient trop acide. Il deviendra ainsi du phosphate monosodique (NaH2PO4 ou dihydrogénophosphate de sodium), qui à son tour se déchargera de son H+ quand le milieu deviendra trop basique. Le système tampon phosphate est surtout utilisé dans les cellules, ainsi qu’au niveau rénal. Le phosphate monosodique formé au niveau rénal se retrouvera dans les urines.
En conclusion : le bicarbonate est donc le principal garant de l’équilibre acido-basique sanguin, car il limite la baisse du pH. Pour cette raison le bicarbonate et souvent appelé "réserve alcaline" ou "réserve basique".
Le devenir des Lactates
Ce ne sont pas des déchets, bien au contraire ! La quasi-totalité des molécules lactates redeviennent du pyruvate, ceci sous l’action de l’enzyme LDH qui lui retire 2 H+ (prit en charge par un NAD+). Bien que les muscles soient les principaux générateurs de lactates, ils n’assureront pas la totalité du processus rétroactif lactates / pyruvate, car une partie des lactates sera rejetée dans le sang afin d’être captée par des organes vitaux. Voici la répartition du devenir et de l’utilisation des lactates :
- 60 % par les muscles sollicités, dans un but énergétique immédiat (acétyl-CoA, Krebs, Chaine respiratoire).
- 22 % par le foie, à des fins de néoglucogenèse.
- 10 % par les reins (¾ des lactates y seront utilisés dans un but énergétique immédiat, le ¼ restant servira à la néoglucogenèse).
- 7,5 % par le cœur, dans un but énergétique immédiat.
À noter enfin qu’une infime partie des lactates sera rejetée de l’organisme via la sueur et les urines.
Copyright © 2025 BODYBUILDING-COACH.FR
All Rights Reserved - Textes et Contenu déposés et protégés - Website developed by Yohann DASTAIN
--> Photos des Compétitions et des Compétiteurs : cliquez sur l'un des logos
--> Photos des Compétitions et des Compétiteurs : cliquez sur le logo
Bodybuilding Masculin, focus sur
Chris Bumstead
Chris Bumstead
• 2015 - CBBF Championships, Men’s Junior, 1st
• 2016 - CBBF Championships, Open Heavyweight, 2nd
• 2016 - IFBB North American Championships, 1st (Pro Card)
• Mr Olympia Classic Physique : 2nd in 2017 and 2018 ; Winner from 2019 to 2024
• 2016 - CBBF Championships, Open Heavyweight, 2nd
• 2016 - IFBB North American Championships, 1st (Pro Card)
• Mr Olympia Classic Physique : 2nd in 2017 and 2018 ; Winner from 2019 to 2024


Histoire du Bodybuilding, Rétrospective sur
Larry Scott
Larry Scott
» Ses meilleurs résultats :
• 1959 - Mr. Idaho, Winner
• 1960 - Mr. California - AAU, Winner
• 1961 - Mr. Pacific Coast - AAU, Winner
• 1962 - Mr. America IFBB, Winner
• 1963 - Mr. Universe IFBB, 1st in Medium
• 1964 - Mr. Universe IFBB, Winner
• 1965 - Mr. Olympia, Winner
• 1966 - Mr. Olympia, Winner
• 1960 - Mr. California - AAU, Winner
• 1961 - Mr. Pacific Coast - AAU, Winner
• 1962 - Mr. America IFBB, Winner
• 1963 - Mr. Universe IFBB, 1st in Medium
• 1964 - Mr. Universe IFBB, Winner
• 1965 - Mr. Olympia, Winner
• 1966 - Mr. Olympia, Winner










.png)
.png)
.png)



